


Molaridad: La molaridad (M), o concentración molar, es el número de moles de soluto por cada litro de disolución. Por ejemplo, si se disuelven 0,5 moles de soluto en 1000 mL de disolución, se tiene una concentración de ese soluto de 0,5 M (0,5 molar). Para preparar una disolución de esta concentración habitualmente se disuelve primero el soluto en un volumen menor, por ejemplo 300 mL, y se traslada esa disolución a un matraz aforado, para después enrasarlo con más disolvente hasta los 1000 mL.

Es el método más común de expresar la concentración en química, sobre todo cuando se trabaja con reacciones químicas y relaciones estequiométricas. Sin embargo, este proceso tiene el inconveniente de que el volumen cambia con la temperatura.
Se representa también como: M = n / V, en donde "n" son los moles de soluto y "V" es el volumen de la disolución expresado en litros.
Normalidad: La normalidad (N) es el número de equivalentes (eq-g) de soluto (sto) por litro de disolución (Vsc). El número de equivalentes se calcula dividiendo la masa total por la masa de un equivalente: n = m / meq, o bien como el producto de la masa total y la cantidad de equivalentes por mol, dividido por la masa molar:  .
.
Molalidad: La molalidad (m) es el número de moles de soluto por kilogramo de disolvente (no de disolución). Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
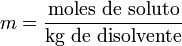
La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de lapresión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está en función del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión.
Es menos empleada que la molaridad pero igual de importante. [5]
DISOLUCIONES

UNIDADES FISICAS
Porcentaje masa/masa (% m/m): expresa la cantidad de gramos de soluto que existen por cada 100 gramos de disolución.
Ej: Disolución azucarada al 5 % m/m. Ello indica que dicha disolución contiene: a) 5g de azúcar por cada 100 g de disolución.
b) 5g de azúcar en 95 g de agua.
c) 95 g de solvente por cada 100 g de disolución.
CALCULO:
Se disuelve 0,5 gramos de AgN03 en 40 gramos de agua. Calcular la concentración de la disolución en % m/m.
DATOS
sto= 0,5g sol= ?
ste= 40g C= ?
- calculando masa de disolución:
m disol = m sto + m ste =====> m disol = 0,5g + 40g =40,5 g disol.
.
0,5 g sto
b) % m/m= 100 g disol x ------------- 1,23 g sto/100g disol.
40,5g sol
=====> por definición: C = 1,23 % m/m.
b) % masa/volumen ( % m/V): expresa la cantidad en gramos de soluto que hay por cada 100 cm3 de disolución.
EJ: Se tienen 400cm3 de una disolución alcalina al 10% m/V. Calcule la cantidad de soluto.
DATOS:
C= 10 % m/V.
Vdisol= 400 cm3.
- el 10% m/V expresa que por cada 100 cm3 de disolución hay 10 gramos de alcalis.
10 g sto
msto= 400 cm3 disol x ------------------- = 40 g sto.
100cm3 disol.
c) Porcentaje volumen/ volumen: expresa la cantidad de cm3 de soluto que hay por cada 100 cm3 de disolución.
Ej: ¿Qué cantidad de agua se ha de agregar a 60 cm3 de alcohol etílico para que la disolución resultante sea 2,5 % V/V?
DATOS:
C= 2,5 % V/V.
ste= ?
sto= 60 cm3.
La concetración del 2,5 % V/V expresa que existen 2,5 cm3 de alcohol por cada 100 cm3 de disolución; ó 2,5 cm3 de alcohol por cada 97,5 cm3 de disolvente.
2,5 % v/v= 100 cm3 sol - 2,5 cm3 sto= 97,5 cm3 de disolvente.
97,5 cm3
V diste = 60 cm3 sto x ---------------- = 2 340 cm3 diste.
2,5 cm3 sto
d) Concentración en g/L: expresa la cantidad en gramos de soluto que hay por cada litro de disolución.
Ej: Se disuelven 4,5 gramos de CuS04 en agua hasta obtener 700 cm3 de sol. Calcular la concentración en g/L.
DATOS
m sto= 4,5 g CuS04
Vsol= 700 cm3
C= ? ( g/L)
1 L
- V disol= 700 cm3 x ------------- = 0,7 L
- b) C= ------------------ = 6,43 g/L
1000 cm3
4,5 g CuS04
0,7 L

No hay comentarios:
Publicar un comentario