Considere un sistema termodinámico que contiene n especies constitutivas. Su energía interna total U se postula como una función de la entropía S, el volumen V, y la cantidad de materia (o de sustancia) de cada especie n1,..., nn:
Refiriéndonos a U como la energía interna, remarcamos que las contribuciones de energía resultantes de las interacciones entre el sistema y los objetos externos están excluidas. Por ejemplo, la energía potencial gravitacional del sistema con la Tierra no está incluida en U.
El potencial químico de la especie i del sistema, μi se define como la derivada parcial:
donde los subíndices indican simplemente que la entropía, el volumen, y la cantidad de materia de las otras especies deben ser mantenidos constantes.
En sistemas reales, generalmente resulta difícil mantener la entropía constante, ya que esto implica un buen aislamiento térmico. Por lo tanto, es más conveniente definir la energía libre de Helmholtz A, que es una función de la temperatura T, el volumen, y la cantidad de materia:2
El potencial químico definido a partir de la energía libre de Helmholtz sería:
Los experimentos de laboratorio se realizan a menudo bajo condiciones de presión y temperatura constantes. En estas condiciones, el potencial químico es la derivada parcial de la energía libre de Gibbs respecto a la cantidad de materia:
Una expresión similar para el potencial químico puede ser escrita a partir de la derivada parcial de la entalpía, bajo condiciones de entropía y presión constantes. [1]
POTENCIAL DE DIFUSION:
Un potencial eléctrico vinculado a la difusión de iones que tienen distinta permeabilidad, a favor de un gradiente de concentración.
- Formas en que un potencial de difusión puede mantenerse. Los potenciales de difusión duran el mismo tiempo que las diferencias de concentración y desaparecen cuando ellas se disipan. Si, en un sistema, encontramos un potencial que suponemos es de difusión y éste se mantiene constante, sin decaer o desaparecer con el tiempo, debemos buscar cuál es el mecanismo que está manteniendo las CONCENTRACIONES CONSTANTES.
Analizaremos varias posibilidades:
a) Uno de los compartimientos tiene un ion no difusible.
b) A uno de los compartimientos le llega un flujo constante de iones.
c) Hay un mecanismo de transporte activo que "bombea" los iones que se pierden del compartimiento.[2]
POTENCIAL DONNAN:
El equilibrio de Gibbs - Donnan es el equilibrio que se produce entre losiones que pueden atravesar la membrana y los que no son capaces de hacerlo. Se juega con los iones y con las cargas.
Cuando partículas de gran tamaño cargadas eléctricamente, como las proteínas, que no se difunden a través de una membrana semipermeable están presentes en un compartimento fluido como el vascular, atraen los iones cargados positivamente y repelen los iones cargados negativamente (tal y como aparece en la figura). Como consecuencia de ello, se establece un gradiente eléctrico y sendos gradientes de concentración de los iones, estos dos últimos iguales y de signo opuesto. En el equilibrio, los productos de las concentraciones iónicas de cada lado de la membrana son iguales. En consecuencia, la concentración de partículas es desigual a ambos lados de la membrana y se establece un gradiente osmótico en dirección hacia el compartimiento que contiene las proteínas. Esta presión osmótica en el equilibrio de Gibbs-Donnan es de unos 6-7 mm de Hg. El efecto de Donnan sobre la distribución de los iones difusibles es importante en el organismo a causa de la presencias en las células y en el plasma.[3]

POTENCIAL DE MEMBRANA:
Normalmente hay potenciales eléctricos a través de las membranas en todas las células. De las cuales:
- Las células nerviosas y musculares son AUTOEXCITABLES
- Es decir, son capaces de autogenerar impulsos electroquímicos
- En sus membranas, y en muchos casos, de transmitir señales a
- Lo largo de las mismas.
1.1.-POTENCIALES DE MEMBRANA CREADAS POR DIFUSIÓN
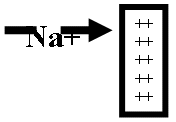
[ Na +] intracelular > [ Na ] intracelular = difunde = > cargas + intracel = pero, luego la difusion se frena por esas cargas (+) = POTENCIAL DE NERNST
1.2.-CONCEPTOS
Cuando el potencial de membrana es generado por la por difusión de diferentes iones (por diferente permeabilidad a la membrana)
Depende de:
* polaridad de la carga eléctrica de cada ión.
* permeabilidad de la membrana para cada ión.
* [ ] de cada uno de los iones en el int-ext celular.
Esos iones son:
Na+ K+ Cl-
= desarrollan potenciales de membrana en membranas de células neuronales, musculares y nervios de conducción.
= el gradiente de [ ] de cada uno a través de la membrana determina el
La permeabilidad de los canales de Na y K sufren cambios durante la conducción del impulso nervioso. Mientras que los canales de Cl. no cambian, por lo tanto los cambios de
permeabilidad para Na y K son importantes para la: TRANSMISIÓN DE LA SEÑAL A LOS NERVIOS.
Potencial de reposo en la membrana de la célula nerviosa
- De reposo: cuando no están transmitiendo señales = - 90 Mv
- Es producido por:
- DIFUSIÓN PASIVA DEL K: a través de un canal proteico = - 94 Mv
- DIFUSIÓN PASIVA DEL Na: a través de canales proteicos pero con menos permeabilidad que el K = + 61 Mv
La combinación de ambos genera un POTENCIAL NETO de – 86 Mv. Donde la bomba de sodio y potasio es:
BOMBA Na-K: Saca 3 Na+ y mete 2 K = - 90 Mv. [4]
ELECTRODOS Y SUS APLICACIONES:
Un electrodo es un conductor utilizado para hacer contacto con una parte no metálica de un circuito, por ejemplo un semiconductor, un electrolito, el vacío (en una válvula termoiónica), un gas (en una lámpara de neón), etc. La palabra fue acuñada por el científico Michael Faraday y procede de las voces griegas elektron, que significa ámbar y de la que proviene la palabraelectricidad y hodos, que significa camino.
TIPOS:
Electrodo de pH de punta aguda y cuerpo de vidrio ▼ Para prueba de Gel, semisólidos y materiales de plantas o animales La punta aguda es ideal para pruebas en semisólidos. Escoja electrodos de junta sencilla o doble; ambos tienen junta tipo anular para una respuesta más rápida del electrodo. Electrodos de pH rellenables, de doble junta y cuerpo de vidrio ▼ Uso en aplicaciones de alto grado de laboratorio ▼ Estos electrodos grado-laboratorio son ideales para pruebas de agua sucia y soluciones con metales pesados y elementos orgánicos. La junta tipo Anular brinda una respuesta de electrodo más rápida. Electrodos de pH rellenables, junta doble, cuerpo epóxico ▼ Con junta lavable con descarga de agua—para usar con sustancias que normalmente obstruyen los electrodos estándar Ideal para pruebas de agua sucia, suspensiones, aceites, pinturas, pastas, soluciones de baja fuerza iónica y soluciones con metales pesados u orgánicos. La junta anular lavable permite limpiar la junta oprimiendo la tapa del electrodo— limpia las obstrucciones instantáneamente. Número de Catálogo Tipo Long. Cable WD-35805-09 Estándar 3 pies Número de Catalogo Tipo Long. Cable Rango Estándar de 0 a 12 pH WD-35805-04 Estándar 3 pies Rango alto de 0 a 14 pH WD-35805-08 Estándar 3 pies WD-35811-74 Acorn Todo en Uno 3 pies Electrodos de pH llenos de gel, de junta sencilla y cuerpo epóxico ▼ ¡Nuestros electrodos más económicos! ▼ Modelos disponibles de 0 a 14 pH—para uso con soluciones de sodio alto/pH alto Estos electrodos económicos son ideales para usar en el campo agua limpia, y aplicaciones de propósitos generales. Cuentan con una cubierta epóxica resistente. La junta tipo-pin lo provee de un flujo electrolítico bajo para una larga vida. Número de Catalogo Tipo Long. Cable Rango estándar de 0 a 12 pH WD-35801-00 Estándar 3 pies WD-35801-71 Todo en Uno Estándar 30" WD-35811-71 Todo en Uno Acorn® 30" WD-35808-71 Todo en Uno A prueba de agua 30" WD-35816-71 Todo en Uno WP600 30" WD-35804-00 Conexión directa Sin cable Rango alto de 0 a 14 pH WD-35805-05 Estándar 3 pies WD-35801-76 Todo en Uno 30" Especificaciones e Información de Pedidos Temp. Máxima: 80°C (excepto 35801-00: 70°C) Diámetro: 12 mm (excepto 35804-50: 12.5 mm) Junta doble, cuerpo epóxico, electrodos de pH llenos de gel ▼ Uso en pruebas de agua sucia y otras aplicaciones agresivas en campo ▼ Modelos de pH 0 a 14 disponibles—uso en soluciones de pH de sodio alto/pH alto Ideal para la mayoría de las aplicaciones, incluyendo agua sucia y soluciones con metales pesados o elementos orgánicos. La junta tipo pin le provee de un flujo electrolítico bajo para una larga vida. Número de Catalogo Tipo Long. Cable Rango Estándar de 0 a 12 pH WD-35805-01 Estándar 3 pies WD-35641-51 Estándar, poly-gel 3 pies WD-35801-72 Todo en Uno Estándar 30" WD-35811-72 Todo en Uno Acorn 30" WD-35808-72 Todo en Uno A prueba de Agua 30" WD-35816-72 Todo en Uno WP600 30" WD-35804-02 Conexión directa Sin cable Rango alto de 0 a 14 pH WD-35805-06 Estándar 3 pies Especificaciones e Información de Pedidos Temp. Máxima: 80°C Diámetro: 12 mm Especificaciones e Información de Pedidos Temp. Máxima: 100°C Diámetro: 12 mm Especificaciones e Información de Pedidos Rango: 0 a 12 pH Temp. Máxima: 80°C Diámetro: 12 mm Número de Catalogo Tipo Junta Long. Cable WD-35805-18 Estándar Doble 3 pies WD-35804-06 Estándar Solo 3 pies Especificaciones e Información de Pedidos Rango: 0 a 12 pH Temp. Máxima: 100°C Diámetro: OD 12 mm, punta 8 mm Electrodos para Aplicaciones en Laboratorio y Campo
Bibliografía:
- 1 http://es.wikipedia.org/wiki/Potencial_químico
- 2 http://www.elergonomista.com/biologia/biofisica64.html
- 3 http://es.wikipedia.org/wiki/Equilibrio_de_Gibbs_Donnan
- 4 http://www.monografias.com/trabajos41/potencial-membrana/potencial-membrana.shtml
- 5 http://es.wikipedia.org/wiki/Electrodo
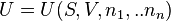




No hay comentarios:
Publicar un comentario